DISTRIBUCIÓN DE LOS GASES MEDICINALES
TEORÍA CINECTICA
DE LOS GASES
•Explica el comportamiento de los gases
utilizando un modelo teórico, suministra un modelo mecánico.
EJEMPLO
Hay que tener en cuenta que:
1. No existen fuerzas de atracción entre la moléculas de un gas.
2. Las moléculas de los gases se mueven constantemente en línea recta por lo que poseen energía cinética.
3. En el movimiento, las moléculas de los gases chocan elástica mente unas con otras y con las paredes del recipiente que las contiene en una forma perfectamente aleatoria.
4. La frecuencia de las colisiones con las paredes del recipiente explica la presión que ejercen los gases.
5. La energía de tales partículas puede ser convertida en calor o en otra forma de energía. pero la energía cinética total de las moléculas permanecerá constante si el volumen y la temperatura del gas no varían; por ello, la presión de un gas es constante si la temperatura y el volumen no cambian.
1. No existen fuerzas de atracción entre la moléculas de un gas.
2. Las moléculas de los gases se mueven constantemente en línea recta por lo que poseen energía cinética.
3. En el movimiento, las moléculas de los gases chocan elástica mente unas con otras y con las paredes del recipiente que las contiene en una forma perfectamente aleatoria.
4. La frecuencia de las colisiones con las paredes del recipiente explica la presión que ejercen los gases.
5. La energía de tales partículas puede ser convertida en calor o en otra forma de energía. pero la energía cinética total de las moléculas permanecerá constante si el volumen y la temperatura del gas no varían; por ello, la presión de un gas es constante si la temperatura y el volumen no cambian.
LAS
CONDICIONES DE UN GAS
ØPresión(P) y temperatura absoluta (T), en
grado kelvin ( K), que se Allan
mediante la formula:
Ø
T
K= 273 + t C
Ø Un gas es la que cumple todas las condiciones como las
siguientes.
Ø Ocupa el
volumen del recipiente que lo contiene.
Está formado por un gran número de moléculas.
Está formado por un gran número de moléculas.
Ø Estas moléculas se mueven individualmente al azar en todas direcciones.
Ø La
interacción entre las moléculas se reduce solo
su choque.
Ø Estas condiciones se cumplen con suficiente
aproximación, en los gases a las condiciones normales de presión y temperatura.
LOS
GASES SE DIVIDEN EN TRES ESTADOS :
SOLIDO, LIQUIDO, GASEOSO
SOLIDO, LIQUIDO, GASEOSO
ESTADO SOLIDO: Los sólidos se caracterizan por tener forma y volumen constante. Esto se debe a que las partículas que los
forman están unidas por unas fuerzas de atracción grandes de modo que ocupan
posiciones casi fijas.
ESTADO LIQUIDO: En los líquidos las partículas están
unidas por una fuerza de atracción menores en que los solidos. El numero de
partículas por unidad de volumen es muy alta, por ello son muy frecuentes las
colisiones y fricciones entre ellos.
ESTADO GASEOSO: Un cuerpo gaseoso se denomina
al estado de agregación de la materia en el que las sustancias no
tienen forma ni volumen propio,
adoptando el de los recipientes que las contienen. Las moléculas que
constituyen un gas casi no son atraídas unas
por otras, por lo que se mueven en el vacío a gran velocidad y
muy separadas unas de otras.
LAS
LEYES DE LOS GASES
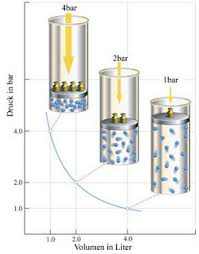
LEY
DE BOYLE-MARIOTTE: Esta
ley dice que, si se mantiene la temperatura constante, cuando se aumenta la
presión de un gas
ideal,
su volumen disminuye en la misma proporción. Es decir P1. V1 = P2 . V2 .
LEY
DE GAY-LUSSAC: Esta
ley dice que si se mantiene la presión constante, el volumen del gas aumentará
en la misma proporción en que aumente su temperatura absoluta:
LEY DE CHARLES: Esta
ley dice que, si se mantiene el volumen constante, la presión de un gas aumenta
en la misma proporción en la que aumenta su temperatura absoluta:
•Leandra Ibica
•Blanca Hidalgo
•Liliana Maldonado
•Deison Fuentes
•Yeimy Tarache
•10 “1”


















No hay comentarios:
Publicar un comentario